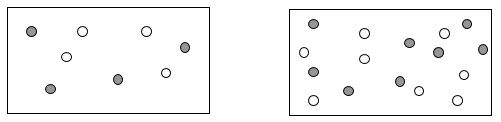
La cinética química hace
referencia a cómo de rápido ocurren las reacciones químicas. Algunas son muy
rápidas, casi instantáneas, mientras que otras son muy lentas. Considera por un
momento dos reactivos gaseosos hipotéticos A y B:
En ambos recipientes, los
reactivos A y B reaccionan entre sí. Cada partícula se mueve aleatoriamente
dentro del recipiente, y solo ocurre la reacción si una partícula de A choca con
otra de B con la fuerza suficiente. Si el choque es débil, no se producirá la
reacción.
1.
¿En qué recipiente habrá más colisiones entre
partículas?
2.
¿En qué recipiente la reacción será más rápida?
Explica por qué.
3.
¿Qué sucederá a la velocidad de las partículas
si se calientan los recipientes? ¿Qué les pasará a la energía de las
partículas? ¿Tendrán las colisiones más o menos energía? ¿Habrá más o menos
colisiones?
4.
De acuerdo con las respuestas a la pregunta
anterior, ¿qué le sucederá a la velocidad de reacción si incrementas la
temperatura? Piensa en dos razones para ello y escríbelas.
En estos esquemas, las flechas indican la dirección en que se mueven las moléculas o átomos:
5.
Cuando sube la temperatura, ¿se mueven más o
menos rápidas las moléculas o átomos?, ¿tienen más o menos energía cinética?
6.
¿En qué se diferencian las colisiones a 200 ºC y
a 25 ºC?
7.
Compara las dos primeras reacciones, ¿en qué se
diferencian?
8.
Compara las dos últimas reacciones, ¿en qué se
diferencian?
9.
Deduce qué dos condiciones debe cumplir una
colisión para que resulte en reacción.
10.
Considera las dos cantidades de azúcar de abajo.
Ambas pesan lo mismo:
¿Cuál de los dos
tiene mayor área superficial? ¿Cuál se disolverá más rápido en agua?
Conclusión: cuanto mayor área, mayor/menor velocidad
de reacción.