1. Reacciones y ecuaciones químicas
Las reacciones químicas son representaciones de un proceso en el que unas sustancias (reactivos) se han transformado en otras diferentes (productos). Generalmente, una reacción no representa fielmente el proceso que sucede a nivel atómico, sino que más bien representa el cambio global que tiene lugar.
En toda reacción química, se cumple que la masa de los productos es igual a la de los reactivos, es decir, que los átomos se reordenan en las reacciones químicas pero no pueden desaparecer. Esto se conoce por ley de Lavoisier o de conservación de la masa. A efectos prácticos, esto significa que las reacciones químicas hay que darlas ajustadas con los coeficientes adecuados que aseguren lo anterior.
Hay muchos tipos de reacciones, Algunos de ellos son:
- de síntesis: varias sustancias se combinan para dar una nueva
2 Mg(s) + O2(g) → 2 MgO(s)
- de descomposición: una sustancia se descompone en otras
CaCO3(s) → CaO(s) + CO2(g)
- de sustitución: una parte de una molécula es sustituida por otro conjunto de átomos
Na2CO3(aq) + CaCl2(aq) → CaCO3(s) + 2 NaCl(aq)
- de combustión: son las reacciones de los combustibles con el oxígeno, en que el resultado es dióxido de carbono y agua
C5H12(l) + 8 O2(g) → 5 CO2(g) + 6 H2O(l)
2. Mecanismo, velocidad y energía de las reacciones
Las reacciones químicas casi nunca ocurren en la manera en las escribimos, de modo que éstas suelen representar simplemente el proceso global, y no las múltiples situaciones intermedias. El conjunto de etapas por las que pasan los reactivos hasta dar los productos se denomina mecanismo de reacción, y su determinación suele ser un proceso muy laborioso y no siempre inequívoco. Por ejemplo, sea la siguiente reacción:
Br2 + H2 → 2 HBr
cuyo mecanismo es el siguiente:
Br2 → 2 Br
Br + H2 → HBr + H
H + Br2 → HBr + Br
H + HBr → H2 + Br
2 Br → Br2
cada una de las etapas anteriores se denomina paso elemental, y de ellos, el más lento es el que condiciona la velocidad de todo el proceso, llamándose por eso paso determinante.
La velocidad de reacción se define como la variación de la concentración de reactivos o productos por unidad de tiempo. Se puede comprobar experimentalmente que la velocidad de reacción depende de los siguientes factores:
- Temperatura, todas las reacciones aumentan su velocidad con la temperatura.
- Concentración, si la concentración de reactivos aumenta, la velocidad aumenta.
- Grado de división, en reacciones donde aparecen dos o más fases, la superficie de contacto entre ambas es crítica,y cuanto mayor sea, mayor será la velocidad de reacción.
- Presencia de catalizadores, los catalizadores son sustancias que aumentan la velocidad de reacción, alterando el mecanismo por el que sucede.
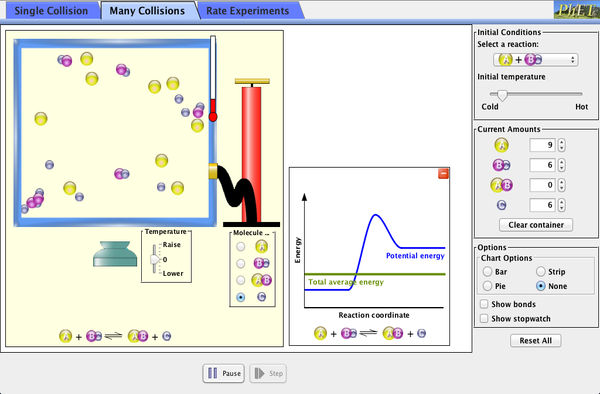
Todas estas características de la velocidad de reacción se pueden explicar mediante la teoría de colisiones, que establece que para que ocurra la reacción, los reactivos tienen que chocar con una mínima energía y una orientación adecuada. De ese modo, más temperatura supone mayor velocidad de las partículas y por tanto mayor velocidad, o más concentración significa más colisiones por unidad de tiempo, y de nuevo más velocidad.
Las reacciones químicas pueden liberar energía o absorberla. Eso depende de si los reactivos tienen más o menos energía que los productos:
3. Equilibrios y reacciones reversibles
El equilibrio químico es una situación en la que una reacción ocurre tanto de reactivos a productos como de productos a reactivos, en ambos casos con la misma velocidad, y como consecuencia, las concentraciones de ambos permanecen constantes. A menudo se dice que el equilibrio químico es dinámico.
Cualquier equilibrio puede alterarse si ejercemos cambios sobre él, y siempre reacciona de la misma forma: oponiéndose a dicho cambio, es decir, si subimos la temperatura, trata de bajarla (se desplaza en sentido endotérmico); si aumentamos la cantidad de un reactivo, trata de disminuirla, desplazándosle hacia los productos, etc. Esto es lo que se conoce como ley de Le Chatelier.
4. Cálculos estequiométricos
Se denomina reactivo limitante de una reacción al que primero se termina, y por tanto determina las cantidades de otros reactivos que reaccionan y las cantidades de productos que se forman.
5. Ácidos y bases.
Por su parte las bases producen pH superiores a 7, no reaccionan ni con Mg ni con los carbonatos, pero sí con los ácidos dando una neutralización (ver abajo).
Definiciones de ácidos y bases de Arrhenius.
Se define ácido como una sustancia que libera iones H+ en disolución acuosa, por ejemplo: HCl, H2SO4, H3PO4,...Se define base como una sustancia que libera iones OH- en disolución acuosa, por ejemplo: NaOH, Ca(OH)2, ... A estos efectos, el amoniaco es una base, puesto que al disolverse en agua se transforma en NH4OH.
En función de que la disociación de la sustancia sea total o parcial, los ácidos y bases se clasifican en fuertes y débiles, respectivamente:
6. pH.
El pH mide la acidez o basicidad de una disolución. Es una escala logarítmica que va de 0 a 14, siendo el pH=7 (agua pura) el pH neutro. Las disoluciones ácidas tienen pH por debajo de 7, siendo más ácidos cuanto más bajos, y las básicas tienen pH por encima de 7 siendo más básicas cuanto más alto. El pH se puede medir cualitativamente mediante papel de pH o cuantitativamente mediante un instrumento denominado pHmetro.7. Reacción de neutralización.
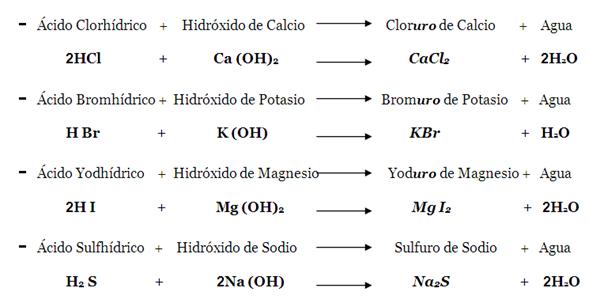
La reacción de neutralización es la típica de ácidos con bases, y el resultado es una sal y agua:
Tiene una importante aplicación analítica en la técnica denominada volumetría ácido-base o titulación ácido-base o valoración ácido-base. (VER PRÁCTICA REALIZADA).









No hay comentarios:
Publicar un comentario