1. Las fuerzas intermoleculares son
interacciones no covalentes entre moléculas. ¿Qué grupo, A o B, solo contiene
fuerzas intermoleculares?
2. Ordena los enlaces y fuerzas
intermoleculares por valores decrecientes de energía. ¿Qué grupo es más fuerte,
A o B?
3. Cuando ves hervir agua, ¿qué
enlaces se están rompiendo: enlaces covalentes O-H o fuerzas intermoleculares entre moléculas de
agua?
Las fuerzas intermoleculares se ven
reflejadas en los puntos de fusión y ebullición de las sustancias.
4. Clasifica las moléculas de la
tabla en polares o apolares.
5. Completa: “Cuanto más polar la
molécula, (mayor/menor) su punto de ebullición”.
6. Completa: “Cuanto más polar la
molécula, más (fuerte/débil) sus fuerzas intermoleculares”.
7. Entre CO y CO2,
¿quién tendrá mayor punto de ebullición? ¿Por qué? (Comprueba luego si has
acertado)
8. Indica el estado físico de cada
molécula de la tabla a temperatura ambiente. ¿Quién crees que tiene las mayores
fuerzas intermoleculares?
9. Clasifica las moléculas de la
tabla en polares o apolares.
10. ¿Hay relación entre polaridad y
punto de ebullición como antes?
11. ¿Qué relación hay entre peso
molecular y punto de ebullición?
12. Completa: “Conforme aumenta el
peso molecular, las fuerzas intermoleculares (aumentan/disminuyen)”
13.
Tu respuesta
anterior, ¿coincide con lo que se observa en esta tabla?
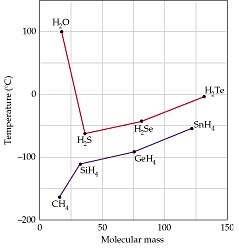
14. De acuerdo con el gráfico de la
derecha, ¿dónde son más fuertes las fuerzas intermoleculares, en SnH4
o CH4?, ¿cómo lo has sabido mirando el gráfico? Explica en un
par de frases por qué el compuesto de tu elección tiene mayores fuerzas
intermoleculares, basándote en lo que has aprendido sobre ellas y su relación
con el peso molecular y la polaridad.
15. La
línea de arriba y la de abajo del gráfico muestran tendencias muy diferentes.
¿Quién tiene fuerzas intermoleculares más fuertes, H2S o H2O?
¿Por qué (principalmente por la polaridad O por el peso molecular)?
16.
Hay tendencias similares en otros compuestos. Mira el gráfico de la
derecha, ¿qué tres compuestos se desvían de la tendencia? Esto indica que estos
tres compuestos tiene fuerzas intermoleculares más (fuertes/débiles) de lo
esperado. Aparte del H, ¿qué otros elementos tienen estos compuestos?
17. Completa:
“Los compuestos que contienen H unido a los elementos ____, ____ y ____, forman
fuerzas intermoleculares muy fuertes denominadas puentes de hidrógeno”.
18. ¿Son
los puentes de hidrógeno como los enlaces covalentes entre el H y otro elemento
(observa la primera tabla de datos)? ¿Cuáles son más fuertes?
19. Compara
NH3 y SbH3. ¿Cuál es más polar? ¿Cuál puede presentar
puentes de hidrógeno? Basándote en la polaridad y los puentes de hidrógeno,
¿cuál esperarías que tuviera las fuerzas intermoleculares más fuertes? ¿Cuál de
los dos tiene las más fuertes, de acuerdo con el gráfico? ¿Por qué?






No hay comentarios:
Publicar un comentario