Teoría cinética de la materia. Calor y temperatura.
Todas las entidades materiales están hechas de partículas, sin entrar en pormenores sobre la naturaleza de las mismas. Dichas partículas tienen un determinado estado de movimiento. Pues bien, la temperatura es una medida de la energía cinética promedio de las partículas que componen un objeto. Cuanto mayor sea esa energía cinética, mayor será la temperatura del objeto.
Cuando dos objetos con distinta temperatura se ponen en contacto, se produce una transferencia de energía del cuerpo con más temperatura al otro. Dicha energía recibe el nombre de calor. La transferencia de calor termina cuando ambos cuerpos alcanzan el equilibrio térmico y poseen la misma temperatura.
El calor se puede transmitir de tres formas:
- por conducción, cuando hay un contacto directo entre ambos cuerpos
- por convección, típico de los fluidos, en los que aparecen corrientes de fluido que transportan partículas más rápidas del foco caliente a las zonas frías
- por radiación, que se da sin contacto, por emisión de radiación, y que es general
Los sólidos tienen forma y volumen definidos; los líquidos tienen volumen definido pero no forma; y los gases, ni una cosa ni la otra. Los sólidos y líquidos se pueden considerar incompresibles. Los líquidos y gases se suelen denominar fluidos, por poseer esa característica.
Material adicional de consulta:
Estados de la Materia: Intro (colorado.edu)
Simulador del comportamiento de los gases ideales
Las leyes de los gases ideales son tres:
La Ley de Boyle-Mariotte: para una cantidad fija de gas a una temperatura determinada, el producto de la presión por el volumen es constante.
Estados de la Materia: Intro (colorado.edu)
Leyes de los gases ideales
Simulador del comportamiento de los gases ideales
Las leyes de los gases ideales son tres:
La Ley de Boyle-Mariotte: para una cantidad fija de gas a una temperatura determinada, el producto de la presión por el volumen es constante.
P1· V1 = P2 · V2
La Ley de Charles: a presión constante, el volumen ocupado por una determinada cantidad de gas es directamente proporcional a su temperatura absoluta. Si la temperatura se expresa en grados kelvin (T(K)=t(ºC)+273), entonces se puede escribir:

La Ley de Gay Lussac: cuando el volumen es constante, la presión ejercida por una determinada cantidad de gas es directamente proporcional a su temperatura absoluta. Si la temperatura se expresa en grados kelvin se puede escribir:

Las tres leyes pueden resumirse en una sola expresión en la que ninguna variable es constante:
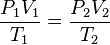
Ecuación de estado de los gases perfectos
Para una determinada cantidad de cualquier gas, sus variables de estado están relacionadas mediante la siguiente expresión

donde p es la presión en atmósferas, V el volumen en litros, n el número de moles del gas, T la temperatura en kelvin y R es la constante de los gases, cuyo valor sólo depende de las unidades en que se exprese y que vale 0.082 atm·L/K·mol.
Constantes y factores de conversión frecuentes en los problemas de gases
1 atm = 760 Torr = 760 mm Hg = 101 300 Pa = 1013 mbar
1 L = 1 dm3; 1 mL = 1 cm3
T(K)=t(ºC)+273
R=0.082 atm·L/K·mol
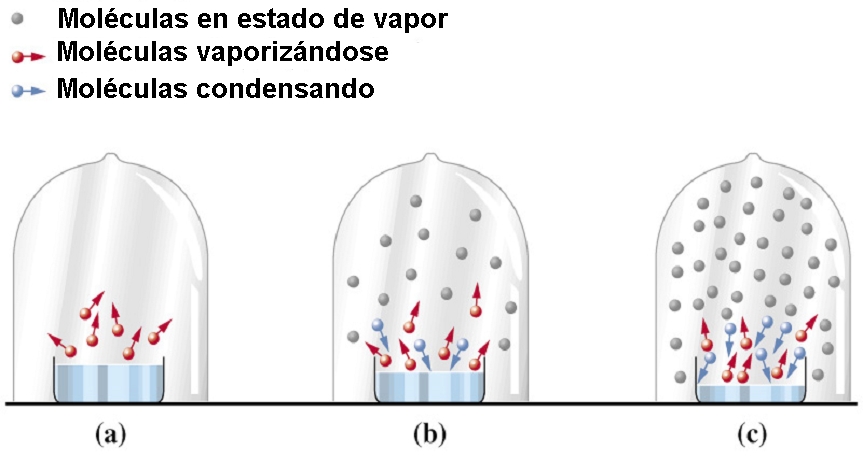
La presión de vapor de un líquido a una temperatura es la presión que ejerce el vapor de ese líquido en equilibrio con él mismo a la temperatura indicada. Es una consecuencia de que la energía cinética de las partículas no es idéntica, sino que presenta una distribución en forma de campana (distribución de Maxwell-Boltzmann) alrededor del valor medio. De esta forma, en todo líquido, a una determinada temperatura, habrá una porción de moléculas con energía suficiente para escapar del líquido y pasar a la fase gas. Conforme se acumule, irá aumentando la presión de ese vapor. Llegado un momento el fenómeno sucede a la inversa y parte de las moléculas del gas pasan al líquido, estableciéndose un equilibrio dinámico cuando la velocidad de evaporación iguala a la de condensación. En ese momento, la presión que ejerce el vapor es la presión de vapor.
Si la temperatura aumenta, más moléculas tienen la capacidad de escapar del líquido, y por lo tanto aumenta la presión de vapor, y viceversa. Cuando ésta llega a la atmosférica, lo que ocurre es que todo el líquido rompe a hervir, así que se puede decir que el punto de ebullición es la temperatura a la cual la presión de vapor del líquido iguala a la atmosférica.
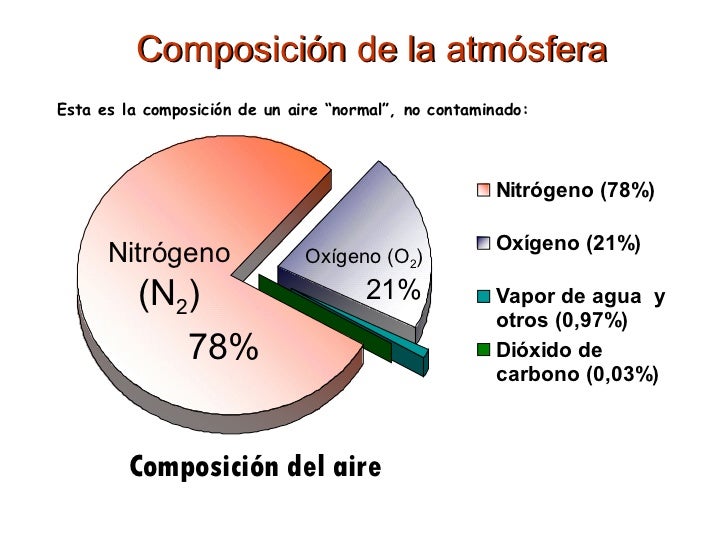
Los componentes de la atmósfera se pueden separar mediante licuación y posterior destilación, aprovechando los diferentes puntos de ebullición de los gases que componen la atmósfera (nitrógeno, -196 ºC; oxígeno: -183 ºC):
Hay varios problemas medioambientales relacionados con la atmósfera:
La atmósfera
La atmósfera es la envoltura gaseosa de la Tierra. Su composición es básicamente nitrógeno-oxígeno con algunas pequeñas cantidades de otros gases, manteniéndose dicha composición constante hasta los 90 km de altura, cambiando luego:
Este gráfico muestra cómo van cambiando la presión, temperatura y composición de la atmósfera con la altura:
Hay varios problemas medioambientales relacionados con la atmósfera:
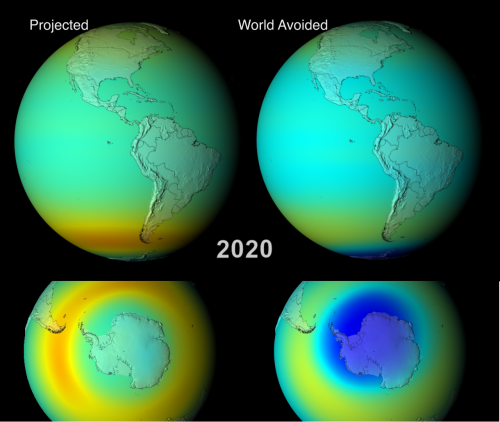
- El agujero y adelgazamiento de la capa de ozono. La capa de ozono es un filtro natural de los perjudiciales rayos ultravioleta que posee la atmósfera. En los años 70, se detectó la aparición de un "agujero" en dicha capa en el polo sur, debido a las condiciones climáticas de esa zona. Las investigaciones posteriores demostraron que el descenso de la concentración de ozono en la atmósfera se debía a las emisiones de unos gases que estábamos usando como propelentes en aerosoles y refrigerantes en los aires acondicionados y frigoríficos: los CFCs. A finales de los 80, se acordó internacionalmente un plan para la sustitución y eliminación de los CFC, que ha dado un magnífico resultado, recuperándose la capa de ozono en buena medida.
- La lluvia ácida. Se debe a la producción de ácidos en aerosol que caen con la lluvia, procedentes de emisiones de óxidos de azufre y de nitrógeno, que dan lugar a ácido sulfuroso y nítrico. Dichos ácidos, al caer sobre la vegetación, literalmente la queman, arruinando la flora y la fauna de la zona. Las soluciones a este problema pasan por dejar de emitir esos óxidos a la atmósfera, cosa que se puede conseguir depurando los combustibles que los generan antes de la combustión o los gases resultante de esta antes de emitirlos a la atmósfera, o bien sustituyendo los combustibles fósiles que originan el problema por fuentes renovables.
- El efecto invernadero. Consiste en la elevación de las temperaturas por la mayor absorción de radiación térmica del Sol por parte de algunos gases que poseen esa capacidad como el dióxido de carbono, el vapor de agua y el metano. El efecto invernadero es lo que posibilita la vida en el planeta, pero en la actualidad, se piensa que las elevadas emisiones de estos gases, especialmente del dióxido de carbono, procedentes de la quema de combustibles fósiles, pueden estar haciendo que las temperaturas suban demasiado en todo el planeta (calentamiento global). Para evitar que este fenómeno prosiga, y que en consecuencia todo el sistema climático se vea afectado, hay en marcha programas de reducción de las emisiones de estos gases, aunque tienen el grave problema de ser antieconómicos para países en vías de desarrollo, con lo que impiden la mejora de la calidad de vida de sus habitantes.







No hay comentarios:
Publicar un comentario